Bài 25. Ankan
I. Đồng đẳng, đồng phân, danh pháp
1. Dãy đồng đẳng ankan
Metan (CH4) và các chất tiếp theo có công thức phân tử C2H6, C3H8, C4H10, C5H12,.. lập thành dãy đồng đẳng ankan (hay parafin) có công thức chung CnH2n+2 (n ≥ 1).
Trong phân tử ankan chỉ có các liên kết đơn C - C, C - H. Các nguyên tử cacbon trong phân tử ankan (trừ C2H6) không cùng nằm trên một đường thẳng.
2. Đồng phân
Từ C4H10 trở đi, ứng với mỗi công thức phân tử có các công thức cấu tạo mạch cacbon không phân nhánh và mạch cacbon phân nhánh của các đồng phân mạch cacbon.
3. Danh pháp
Một số ankan mạch cacbon không phân nhánh được giới thiệu trong bảng sau:
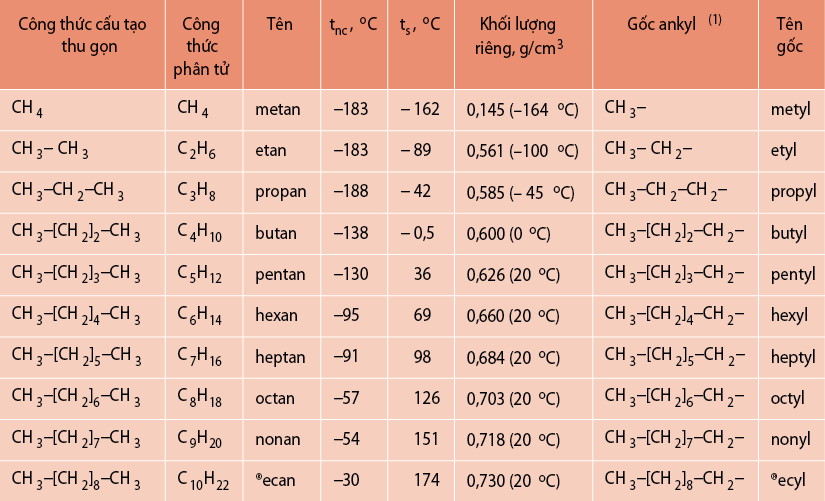
Các ankan có mạch nhánh được gọi tên theo danh pháp thay thế như sau:
- Chọn mạch cacbon dài nhất và có nhiều nhánh nhất làm mạch chính.
- Đánh số thứ tự các nguyên tử cacbon mạch chính từ phía gần nhánh hơn.
- Gọi tên mạch nhánh (nhóm ankyl) theo thứ tự vần chữ cái cùng với số chỉ vị trí của nó, tiếp theo là tên ankan tương ứng với mạch chính (xem bảng trên).
Thí dụ:
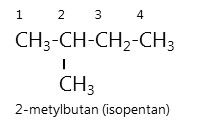
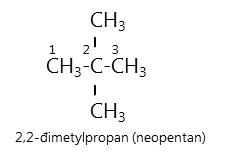
Một số chất có tên thông thường, thí dụ: isopentan, neopentan,...
Bậc của nguyên tử C trong phân tử hiđrocacbon no được tính bằng số liên kết của nó với các nguyên tử cacbon khác.
II. Tính chất vật lí
Ở điều kiện thường, bốn ankan đầu dãy đồng đẳng (từ CH4 đến C4H10) là những chất khí, các ankan tiếp theo là chất lỏng, từ khoảng C18H38 trở đi là những chất rắn.
Nhiệt độ nóng chảy, nhiệt độ sôi và khối lượng riêng của các ankan tăng theo chiều tăng của phân tử khối.
Ankan nhẹ hơn nước và hầu như không tan trong nước, nhưng tan nhiều trong dung môi hữu cơ.
III. Tính chất hóa học
Ở nhiệt độ thường, các ankan không tác dụng với dung dịch axit, dung dịch kiềm và các chất oxi hóa như dung dịch KMnO4 (thuốc tím)...
Khi chiếu sáng hoặc đun nóng, các ankan dễ dàng tham gia các phản ứng thế, phản ứng tách hiđro và phản ứng cháy.
1. Phản ứng thế bởi halogen
Clo có thể thay thế lần lượt từng nguyên tử H trong phân tử metan.
$C{H_4} + C{l_2}\xrightarrow{{as}}C{H_3}Cl + HCl$
clometan (metyl clorua)
$C{H_3}Cl + C{l_2}\xrightarrow{{as}}C{H_2}C{l_2} + HCl$
điclometan (metylen clorua)
$C{H_2}C{l_2} + C{l_2}\xrightarrow{{as}}CHC{l_3} + HCl$
triclometan (clorofom)
$CHC{l_3} + C{l_2}\xrightarrow{{as}}CC{l_4} + HCl$
tetraclometan (cacbon tetraclorua)
Các đồng đẳng của metan cũng tham gia phản ứng thế tương tự metan.
Nhận xét:
Nguyên tử hiđro liên kết với nguyên tử cacbon bậc cao hơn dễ bị thế hơn nguyên tử hiđro liên kết với nguyên tử cacbon bậc thấp hơn.
Các phản ứng trên được gọi là phản ứng halogen hóa. Các sản phẩm thế được gọi là dẫn xuất halogen của hiđrocacbon.
2. Phản ứng tách
Dưới tác dụng của nhiệt và chất xúc tác thích hợp, các ankan có phân tử khối nhỏ bị tách hiđro thành hiđrocacbon không no tương ứng.
Ở nhiệt độ cao và chất xúc tác thích hợp, ngoài việc bị tách hiđro, các ankan còn có thể bị phân cắt mạch cacbon tạo thành các phân tử nhỏ hơn.
3. Phản ứng oxi hóa
Khi bị đốt, các ankan đều cháy, tỏa nhiều nhiệt.
Nếu thiếu oxi, phản ứng cháy của ankan xảy ra không hoàn toàn: sản phẩm cháy ngoài CO2, H2O còn có C, CO,...
IV. Điều chế
1. Trong phòng thí nghiệm
Metan được điều chế bằng cách đun nóng natri axetat khan với hỗn hợp vôi tôi xút:
$C{H_3}COONa{\text{ }} + {\text{ }}NaOH{\text{ }}\xrightarrow{{CaO,{t^o}}}{\text{ }}C{H_4} \uparrow {\text{ }} + {\text{ }}N{a_2}C{O_3}$
2. Trong công nghiệp
Các ankan là thành phần chính của dầu mỏ, khí thiên nhiên và khí mỏ dầu.
Từ dầu mỏ, bằng phương pháp chưng cất phân đoạn, ta thu được các ankan ở các phân đoạn khác nhau.
Từ khí thiên nhiên và khí mỏ dầu cũng thu được các ankan CH4, C2H6, C3H8, C4H10 ...
V. Ứng dụng của ankan
Các ankan được dùng làm nhiên liệu, nguyên liệu cho công nghiệp.



