Bài 1. Sự điện li
I.
HIỆN TƯỢNG ĐIỆN LI
1. Thí nghiệm
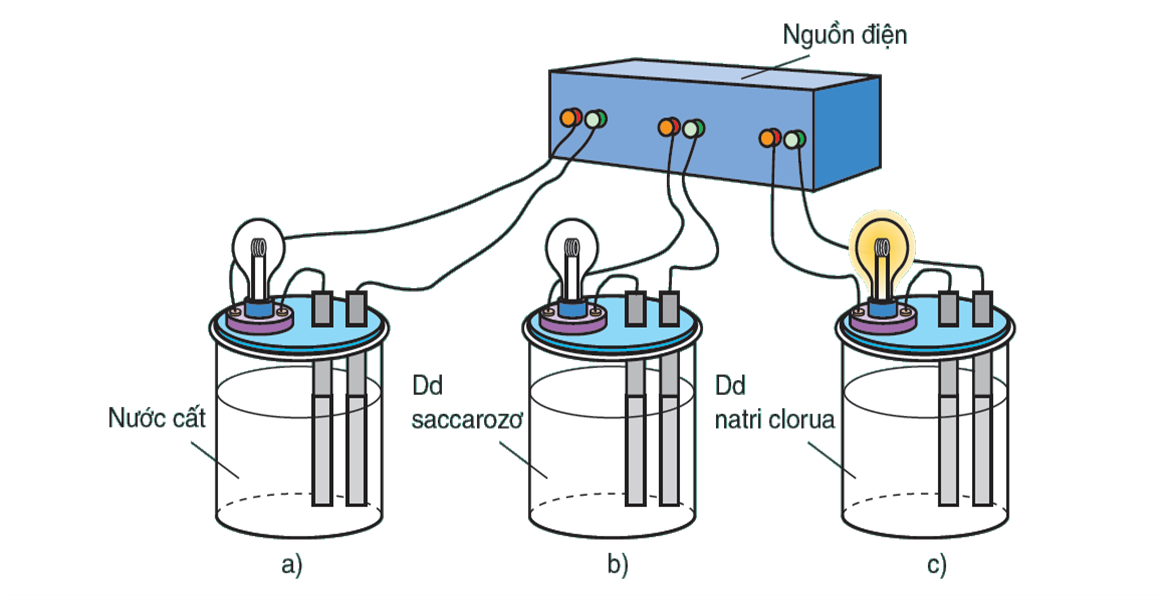
Bộ dụng cụ chứng minh tính dẫn điện của dung
dịch
Khi nối các đầu dây dẫn điện với cùng một nguồn điện, ta chỉ thấy bóng đèn ở cốc đựng dung dịch NaCl bật sáng. Vậy dung dịch NaCl dẫn điện, còn nước cất và dung dịch saccarozơ không dẫn điện.
Nếu làm các thí nghiệm tương tự, người ta thấy: NaCl rắn, khan; NaOH rắn, khan; các dung dịch ancol etylic $\left( {{C_2}{H_5}OH} \right)$, glixerol $\left( {{C_2}{H_5}{{\left( {OH} \right)}_3}} \right)$ không dẫn điện.
Ngược lại, các dung dịch axit, bazơ và muối đều dẫn điện.
2. Nguyên nhân tính dẫn điện của các dung dịch axit, bazơ và muối trong nước
Ngay từ năm 1887, A-rê-ni-ut (S.Arrhenius) đã giả thiết và sau này thực nghiệm đã xác nhận rằng:
Tính dẫn điện của các dung dịch axit, bazơ và muối là do trong dung dịch của chúng có các tiểu phân mang điện tích chuyển động tự do được gọi là các ion.
Quá trình phân li các chất trong nước ra ion là sự điện li. Những chất tan trong nước phân li ra ion được gọi là những chất điện li .
Vậy axit, bazơ và muối là những chất điện li.
Sự điện li được biểu diễn bằng phương trình điện li.
Ví dụ:
- Muối phân li thành cation kim loại và anion gốc axit:
$NaCl \to N{a^ + } + C{l^ - }$
- Axit phân li thành cation ${H^ + }$ và anion gốc axit:
$HCl \to {H^ + } + C{l^ - }$
- Bazơ phân li thành cation kim loại và anion hiđroxit:
$NaOH \to N{a^ + } + O{H^ - }$
3. Định nghĩa sự điện li
- Sự điện li là quá trình phân li thành các ion (cation, anion) khi chất tan vào nước hoặc nóng chảy.
- Chất điện li là những chất khi tan vào nước tạo thành dung dịch dẫn điện nhờ phân li thành ion.
II. PHÂN LOẠI CÁC CHẤT ĐIỆN LI
1. Độ điện li
- Để biểu thị mức độ phân li ra ion của các chất điện li, ta dùng khái niệm độ điện li.
+
Độ điện li $\alpha $ (anpha) của một chất điện li là tỉ số giữa phân tử
phân li thành ion (n) và tổng số phần tử hòa tan (${n_0}$).
$\alpha = \frac{n}{{{n_0}}}$
+ Tỉ lệ phân tử cũng là tỉ lệ với số mol, nên $\alpha $ bằng tỉ số phần nồng độ mol chất tan phân li thành ${C_p}$ và tổng nồng độ mol của chất tan trong dung dịch ${C_t}$:
$\alpha = \frac{{{C_p}}}{{{C_t}}}$
- Độ điện li $\alpha $ phụ thuộc vào:
+ Bản chất của chất tan.
+ Bản chất của dung môi.
+ Nhiệt độ
+ Nồng độ chất điện li.
2. Chất điện li mạnh và chất điện li yếu
a) Chất điện li mạnh
Chất điện li mạnh là chất khi tan trong nước, các phân tử hoà tan đều phân li ra ion, $\alpha = 1$.
Những chất điện li mạnh là các axit mạnh như HCl, $HN{O_3},HCl{O_4},{H_2}S{O_4}$, ...; các bazơ mạnh như NaOH, KOH, $Ba{\left( {OH} \right)_2}$,... và hầu hết các muối.
Trong phương trình điện li của chất điện li mạnh, người ta dùng một mũi tên chỉ chiều của quá trình điện li.
Ví dụ:
$N{a_2}S{O_4} \to 2N{a^ + } + S{O_4}^{2 - }$
b) Chất điện li yếu
Chất
điện li yếu là chất khi tan trong nước chỉ có một phần số phân tử hoà
tan phân li ra ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong
dung dịch.
Những chất điện li yếu là các axit yếu như $C{H_3}COOH,HClO,{H_2}S,HF,{H_2}S{O_3}$, ... ; các bazơ yếu như $Bi{\left( {OH} \right)_3},Mg{\left( {OH} \right)_2}$, ...
Trong phương trình điện li của chất điện li yếu, người ta dùng hai mũi tên ngược chiều nhau.
Ví dụ:
$C{H_3}COOH \rightleftarrows C{H_3}CO{O^ - } + {H^ + }$
Cân bằng điện li là cân bằng động. Giống như mọi cân bằng hoá học khác, cân bằng điện li cũng tuân theo nguyên lí chuyển dịch cân bằng Lơ Sa-tơ-li-ê.



